Des solutions simples et durables qui facilitent l’amélioration de la qualité des données sans nuire à l’innovation et à la liberté de recherche.
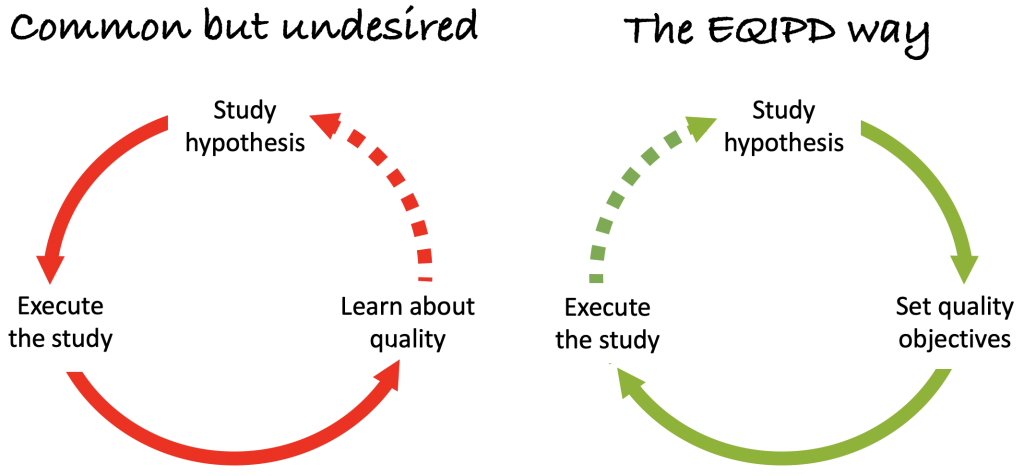
Nous ne discutons souvent de la qualité des données de recherche qu’après la planification d’une étude et la fin d’une expérience (schéma à gauche), ce qui entraîne souvent une perte de temps et de ressources.
La mission principale d’EQIPD est de de s’assurer que toutes les exigences essentielles en matière de qualité sont prises en compte et mises en œuvre pendant la phase de conception de l’étude et avant l’exécution d’une étude (schéma à droite).
Pour atteindre ces objectifs, EQIPD a élaboré :
• un système qualité et le soutien nécessaire pour sa mise en œuvre
• un programme visant à aider les équipes de recherche à préparer une nouvelle proposition de projet tout au long de la phase d’exécution;
• une série de séminaires de formation et d’ateliers pour les jeunes scientifiques;
Veuillez contacter l’équipe d’EQIPD pour obtenir un soutien général ou paul.moser@paasp.net pour obtenir de plus amples informations et de l’aide en français.

À propos d’EQIPD
Le consortium Enhancing Quality in Preclinical Data (EQIPD) a développé des outils simples et durables pour assurer une qualité élevée des données sans nuire ni l’innovation, ni la liberté de recherche.
Le consortium EQIPD, fondé en 2017, travaille en étroite collaboration avec un grand groupe d’acteurs issus d’institutions de recherche, de l’édition, de la finance, de sociétés savantes et de sociétés professionnelles de près de 110 organisations en Europe et aux États-Unis.
Ce site web a été créé et est maintenu par le Groupe de travail EQIPD responsable de la maintenance et de la diffusion à long terme du Système qualité EQIPD et des ressources et services connexes.
Veuillez consulter le site web du consortium EQIPD pour plus d’informations au-delà du système de qualité.

Pourquoi rechercher un label de qualité EQIPD?
Il s’agit d’une évaluation indépendante d’un programme de recherche qui donne lieu à une conception expérimentale améliorée et à des données plus solides provenant de votre propre unité de recherche;
Il accroît la confiance dans les données fournies par un collaborateur, un partenaire de recherche, un fournisseur de services ou un titulaire de subvention;
Il facilite la prise de décisions dans le cadre d’un programme de recherche ou dans la sélection de partenaires de recherche ou de fournisseurs de services (atténuation des risques).
Le système de qualité EQIPD
Soutenu par l’Initiative européenne sur les médicaments innovants (IMI), l’EQIPD a mis au point un nouveau système de qualité pour la recherche préclinique qui peut être appliqué dans les secteurs public et privé. Notre système de qualité assure la génération de données précliniques robustes et fiables tout en étant léger et efficace, ce qui stimule l’innovation. Il répond aux besoins de la recherche biomédicale non réglementée (c.-à-d. les domaines où les systèmes formels de gestion de la qualité, comme les bonnes pratiques de laboratoire – BPL – ne sont pas jugés appropriés).
Le système de qualité EQIPD offre un cadre stable pour le maintien à long terme de normes de recherche élevées. Il ne s’agit pas simplement d’un ensemble de lignes directrices et d’instructions, mais plutôt:
- un outil pour coordonner et diriger les activités d’une organisation afin d’atteindre les objectifs de qualité et d’améliorer l’efficacité et l’efficience de l’organisation de façon continue;
- un miroir que les chercheurs peuvent utiliser pour évaluer leur rendement et ce qui doit être modifié ou amélioré.
Pour de plus amples renseignements, veuillez consulter la plateforme wiki du Système de qualité d’EQIPD, un effort de collaboration de la communauté d’EQIPD pour créer et partager l’information sur les pratiques, les outils et les ressources de recherche exemplaires.

La Label Qualité EQIPD
EQIPD offre aux unités de recherche (laboratoires, départements, entreprises, etc.) deux options différentes pour obtenir un Label Qualité.
Option 1 (certification du système qualité)
La mise en œuvre réussie d’un système qualité EQIPD entièrement fonctionnel est évaluée par l’équipe EQIPD, et est suivie, après un résultat positif, d’une certification complète d’une durée de 3 ans.
Option 2 (certification adaptée à l’objectif)
Une solution flexible adaptée aux besoins d’un projet de collaboration spécifique. L’équipe de l’EQIPD évalue les pratiques de qualité actuelles pour s’assurer qu’elles sont conformes aux attentes de l’EQIPD. Un certificat plus limité est valide pour une période maximale d’un an.

Soutien au projet
EQIPD apporte son soutien aux organisations qui élaborent de nouveaux projets ou des demandes de subvention et qui souhaitent introduire des formations, des évaluations et des contrôles supplémentaires de la qualité de la recherche – par exemple en tant que package de travail séparé dans les propositions de projet.
Ce soutien est divisé en trois parties :
- Partie 1 – Formation générale sur les bonnes pratiques de recherche;
- Partie 2 – Évaluations initiales des pratiques de qualité, rigueur de la recherche, planification et mise en œuvre de solutions pratiques d’amélioration (si nécessaire);
- Partie 3 – Vérifications ponctuelles pour assurer la conformité avec le plan d’étude prédéfini et les bonnes pratiques de recherche, ainsi que l’évaluation de la gestion des accidents critiques et des erreurs.

Formation sur les bonnes pratiques de recherche
EQIPD offre des programmes de formation sous divers formats, allant de courts exposés introductifs (de 2 à 4 heures) à des cours de formation et à des séries de séminaires pour les étudiants, les postdoctorants, les jeunes chercheurs et les scientifiques établis.
- Le programme de formation EQIPD couvre les aspects clés de la qualité des données dans la recherche biomédicale, notamment :
- La discussion sur la « reproductibilité » : l’étendue du problème
- La robustesse vs la reproductibilité
- Les origines de la faible robustesse des données
- L’étude de la conception et de la puissance
- La valeur prédictive positive
- L’importance du contrôle des conditions expérimentales
- La généralisabilité des résultats de la recherche
- Les éléments clés des bonnes pratiques de recherche
- La déclaration des détails méthodologiques
- L’application des normes de conception des études cliniques à la recherche préclinique
- La confirmation des résultats de la recherche dans un plus large éventail de conditions
- Le rapportage correcte de l’analyse des données statistiques
- La culture de tolérance envers les données négatives
- Les conséquences d’un manque de rigueur dans la recherche

