Soluzioni semplici e facilmente applicabili che permettono di migliorare la qualità dei dati senza limitare la ricerca e la capacità di innovazione.
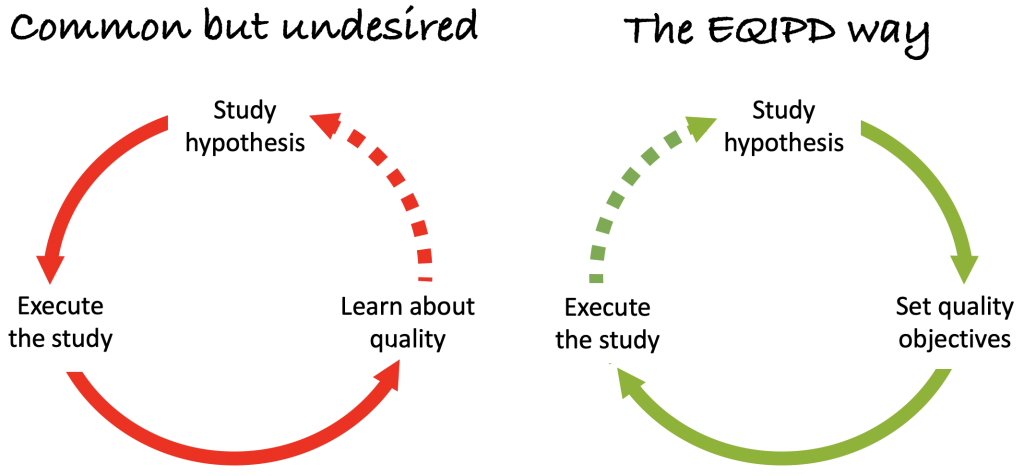
Spesso la qualità dei dati ottenuti da uno studio viene discussa solo dopo che questo è stato pianificato e concluso (schema a sinistra) – il che porta in molti casi a una perdita di tempo e risorse.
La missione principale di EQIPD è assicurare che tutti i requisiti essenziali che assicurano la qualità dei dati vengano considerati e implementati durante la fase di definizione dello studio e prima che lo studio venga eseguito (schema a destra).
Per raggiungere questi obbiettivi, EQIPD ha sviluppato:
- Un sistema di qualità e supporto alla sua realizzazione
- Un programma a supporto dei gruppi di ricerca a partire dalla stesura del progetto fino alla fase di esecuzione
- Una serie di seminari e workshops per giovani ricercatori
Per informazioni generali contattate il renza.roncarati (at) paasp.net per ulteriori specifiche informazioni in Italiano e supporto a progetti in Italia.

Su EQIPD
Il consorzio Enhancing Quality in Preclinical Data (EQIPD) (Miglioramento della Qualità nella Ricerca Preclinica) ha sviluppato uno strumento semplice e sostenibile per assicurare una elevata qualità dei dati senza intaccare la possibilità di innovazione e la libertà della ricerca.
Il consorzio EQIPD, fondato nel 2017, collabora strettamente con un ampio gruppo di stakeholders provenienti da istituti di ricerca, gruppi editoriali, finanziatori, associazioni culturali e professionali che rappresentano all’incirca 110 organizzazioni in Europa e negli Stati Uniti.
IL sito web è stato creato e viene mantenuto dalla EQIPD task force che si occupa del mantenimento a lungo termine e della diffusione del Sistema di Qualità EQIPD, delle risorse e dei servizi ad esso associati.
Per informazioni più dettagliate sul Sistema di Qualità, visitate il sito del consorzio EQIPD.

Perché richiedere il Marchio di Qualità EQIPD?
È una valutazione indipendente di un programma di ricerca che permette di ottenere nella propria unità di ricerca una migliore definizione del piano sperimentale e dati più robusti.
Aumenta l’affidabilità nei dati prodotti da collaboratori, partner della ricerca, fornitori di servizi, beneficiari.
Facilita il processo decisionale nell’ambito di un programma di ricerca o nella selezione dei collaboratori e aziende che forniscono servizi (mitigazione dei rischi).
Il Sistema di Qualità EQIPD
Con il sostegno del programma Innovative Medicines Initiative (IMI) dell’Unione Europea, EQIPD ha sviluppato un nuovo sistema di qualità dedicato alla ricerca preclinica che può essere applicato sia nel settore pubblico-accademico che in quello privato. Il nostro sistema di qualità garantisce la produzione di dati preclinici robusti e affidabili, essendo nello stesso tempo snello ed efficace, ed in grado di promuovere l’innovazione. Si applica alle aree della ricerca biomedica in cui le Buone Pratiache di Laboratorio, BPL (Good Laboratory Practices, GLP) non sono considerate appropriate.
Il sistema di qualità EQIPD fornisce una guida stabile e a lungo termine per il mantenimento di elevati standard di ricerca. Non è una mera collezione di linee guida e istruzioni ma soprattutto:
- Uno strumento per coordinare e dirigere le attività di una organizzazione per farle ottenere gli obbiettivi di qualità prefissati e migliorare efficacia ed efficienza in maniera continuativa e duratura.
- Uno “specchio” che i ricercatori possono usare per valutare la propria performance e cosa deve essere cambiato o migliorato.
Per maggiori informazioni visitate la piattaforma wiki del Sistema di Qualità EQIPD www.eqipd-toolbox.paasp.net, una promessa di collaborazione della comunità EQIPD per creare e scambiare informazioni sulle pratiche, strumenti e risorse per la ricerca.

Il marchio di qualità EQIPD
EQIPD offre alle unità di ricerca (laboratori, dipartimenti, aziende ecc.) due opzioni per ottenere il marchio di qualità.
Opzione 1 – (Certificazione Sistema Qualità)
il gruppo di EQUPD stima l’effettiva implementazione di un completo sistema di qualità EQIPD, e in seguito a una valutazione positiva conferisce la piena certificazione che ha validità di tre anni.
Opzione 2 – (Certificazione Purpose-fit)
Una soluzione flessibile basata sugli obbiettivi di uno specifico progetto di ricerca. Il gruppo EQIPD valuta le pratiche correnti in accordo con i criteri di EQIPD. Il certificato ottenuto è più limitato e valido per il massimo di un anno.

Supporto ai progetti
EQIPD offre consulenza alle organizzazioni che stanno sviluppando nuovi progetti o richiedendo fondi e sono interessate ad inserire in un “grant proposal” – per esempio come “Work Packages” aggiuntivi – programmi di educazione, verifica e monitoraggio sulla qualità della ricerca.
La consulenza si suddivide in tre parti
1° Parte – Corso generale su “Good Research Practice”
2° Parte – Verifica iniziale delle pratiche relative alla qualità, rigore nella pianificazione della ricerca e realizzazione di soluzioni pratiche per il miglioramento (se necessario)
3° Parte – Controlli casuali per verificare la conformità con il piano di ricerca predefinito e con “Good Research Practice” ed è inoltre prevista una valutazione della corretta gestione degli incidenti critici e degli errori.

Corso su “Good Research Practice” (Buone Prassi della Ricerca)
EQIPD offre programmi di formazione in vari formati a partire da brevi lezioni (2-4 ore) a corsi e serie di seminari per studenti, giovani ricercatori, post-dottorandi e ricercatori.
Il programma di formazione copre aspetti chiave sulla qualità dei dati nella ricerca biomedica tra cui:
- Discussione sulla “riproducibilità”: Ampiezza del problema
- Robustezza verso riproducibilità
- Origine della scarsa robustezza
- Impostazione dello studio
- Valore predittivo positivo
- Importanza del controllo delle condizioni dell’esperimento
- Generalizzabilità dei risultati
- Fondamenti del Good Research Practice (Buona Prassi della Ricerca)
- Comunicazione della metodologia sperimentale
- Applicazione degli standard della ricerca clinica alla ricerca preclinica
- Conferma dei risultati di una ricerca in un’ampia serie di condizioni
- Corretta presentazione delle analisi statistiche
- Cultura della tolleranza dei dati negativi
- Conseguenza della mancanza di rigore nella ricerca scientifica

